Ciclo do carbono nos oceanos
Hoje, Ciclo do carbono nos oceanos é um tema que desperta grande interesse na sociedade. Durante décadas, Ciclo do carbono nos oceanos tem sido objeto de estudo, debate e análise em diversos campos, desde a ciência e tecnologia até à arte e cultura. A importância de Ciclo do carbono nos oceanos está na sua influência no dia a dia das pessoas e na sua capacidade de gerar mudanças significativas no mundo. Neste artigo exploraremos diferentes perspetivas relacionadas com Ciclo do carbono nos oceanos, analisando o seu impacto na sociedade atual e refletindo sobre o seu papel no futuro.
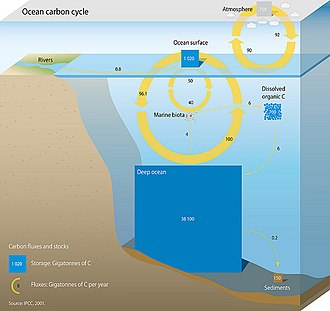
O ciclo do carbono nos oceanos (ou ciclo marinho do carbono) é composto por processos que trocam carbono entre vários reservatórios no oceano, bem como entre a atmosfera, o interior da Terra e o fundo do mar. O ciclo do carbono é o resultado de muitas forças que interagem em várias escalas de tempo e espaço, que fazem o carbono circular pelo planeta, garantindo que ele esteja disponível globalmente. O ciclo oceânico do carbono é um processo central para o ciclo global do carbono e abrange tanto o carbono inorgânico [en] (carbono não associado a um ser vivo, como o dióxido de carbono) quanto o carbono orgânico (carbono que é, ou foi, incorporado a um ser vivo). Parte do ciclo do carbono marinho compreende a transformação do carbono entre matéria viva e não viva.
Três processos principais (ou bombas) que compõem o ciclo do carbono marinho trazem o dióxido de carbono (CO2) atmosférico para o interior do oceano e o distribuem pelos ecossistemas marinhos. Essas três bombas são: (1) a bomba de solubilidade, (2) a bomba de carbonato e (3) a bomba biológica. O total de carbono ativo na superfície da Terra por períodos inferiores a 10 000 anos é de aproximadamente 40 000 gigatoneladas de C (Gt C, uma gigatonelada é um bilhão de toneladas, ou o peso de aproximadamente 6 milhões de baleias azuis), e cerca de 95% (~38 000 Gt C) é armazenado no oceano, principalmente como carbono inorgânico dissolvido [en].[1][2] A diversidade do carbono inorgânico dissolvido no ciclo de carbono marinho é o principal controlador da química ácido-base nos oceanos.
As plantas e as algas da Terra (produtores primários) são responsáveis pelos maiores fluxos anuais de carbono. Embora a quantidade de carbono armazenada na biota marinha (~3 GtC) seja muito pequena em comparação com a vegetação terrestre (~610 GtC), a quantidade de carbono trocada (o fluxo) por esses grupos é quase igual - cerca de 50 GtC cada.[1] Os organismos marinhos vinculam os ciclos de carbono e oxigênio por meio de processos como a fotossíntese.[1] O ciclo do carbono marinho também está biologicamente ligado aos ciclos do nitrogênio e do fósforo por uma relação estequiométrica quase constante C:N:P de 106:16:1, também conhecida como relação Redfield Ketchum Richards (RKR),[3] que afirma que os organismos tendem a absorver nitrogênio e fósforo incorporando novo carbono orgânico. Da mesma forma, a matéria orgânica decomposta por bactérias libera fósforo e nitrogênio.
Com base nas publicações da NASA, da Organização Meteorológica Mundial, do IPCC e do Conselho Internacional para a Exploração do Mar, bem como de cientistas da NOAA, do Instituto Oceanográfico de Woods Hole, do Instituto de Oceanografia Scripps, da CSIRO e do Laboratório Nacional de Oak Ridge, os impactos humanos no ciclo do carbono marinho são significativos.[4][5][6] Antes da Revolução Industrial, o oceano era uma fonte líquida de CO2 para a atmosfera, enquanto agora a maior parte do carbono que entra no oceano vem do dióxido de carbono atmosférico (CO2).[7]
Nas últimas décadas, o oceano atuou como um sumidouro de CO2 antropogênico, absorvendo cerca de um quarto do CO2 produzido pelos seres humanos por meio da queima de combustíveis fósseis e mudanças no uso da terra.[8] Ao fazer isso, o oceano agiu como um amortecedor, retardando um pouco o aumento dos níveis de CO2 atmosférico. No entanto, essa absorção de CO2 antropogênico também causou a acidificação dos oceanos.[7][9] A mudança climática, resultado desse excesso de CO2 na atmosfera, aumentou a temperatura do oceano e da atmosfera.[5] A taxa reduzida de aquecimento global ocorrida entre 2000 e 2010[10] pode ser atribuída a um aumento observado no conteúdo de calor do oceano superior.[11][12]
Carbono marinho
Os compostos de carbono podem ser distinguidos como orgânicos ou inorgânicos, e dissolvidos ou particulados, dependendo de sua composição. O carbono orgânico forma a espinha dorsal dos principais componentes dos compostos orgânicos, como proteínas, lipídios, carboidratos e ácidos nucleicos. O carbono inorgânico é encontrado principalmente em compostos simples, como dióxido de carbono, ácido carbônico, bicarbonato e carbonato (CO2, H2CO3, HCO3-, CO32-, respectivamente).
O carbono marinho é ainda separado em fases particuladas e dissolvidas. Esses grupos são definidos operacionalmente pela separação física - o carbono dissolvido passa por um filtro de 0,2 μm, enquanto o carbono particulado não.
Carbono inorgânico
Há dois tipos principais de carbono inorgânico encontrados nos oceanos. O carbono inorgânico dissolvido [en] (DIC) é composto de bicarbonato (HCO3-), carbonato (CO32-) e dióxido de carbono (incluindo CO2 dissolvido e ácido carbônico H2CO3). O DIC pode ser convertido em carbono inorgânico particulado [en] (PIC) por meio da precipitação de CaCO3 (biológica ou abiótica). O DIC também pode ser convertido em carbono orgânico particulado (POC) por meio da fotossíntese e da quimioautotrofia (ou seja, produção primária). O DIC aumenta com a profundidade à medida que as partículas de carbono orgânico afundam e são respiradas. O oxigênio livre diminui com o aumento do DIC porque o oxigênio é consumido durante a respiração aeróbica.
O carbono inorgânico particulado (PIC) é a outra forma de carbono inorgânico encontrada no oceano. A maior parte do PIC é o CaCO3 que compõe as conchas de vários organismos marinhos, mas também pode se formar em eventos de esbranquiçamento [en]. Os peixes marinhos também excretam carbonato de cálcio durante a osmorregulação.[13]
Algumas das espécies de carbono inorgânico no oceano, como o bicarbonato e o carbonato, são os principais contribuintes para a alcalinidade, um amortecedor natural do oceano que evita mudanças drásticas na acidez (ou pH). O ciclo do carbono marinho também afeta as taxas de reação e dissolução de alguns compostos químicos, regula a quantidade de dióxido de carbono na atmosfera e a temperatura da Terra.[14]
Carbono orgânico
Assim como o carbono inorgânico, há duas formas principais de carbono orgânico encontradas no oceano (dissolvido e particulado). O carbono orgânico dissolvido (DOC) é definido operacionalmente como qualquer molécula orgânica que possa passar por um filtro de 0,2 μm. O DOC é convertível em carbono orgânico particulado por meio da heterotrofia e também pode ser convertido novamente em carbono inorgânico dissolvido (DIC) por meio da respiração.
Essas moléculas de carbono orgânico capturadas pelo filtro são definidas como carbono orgânico particulado (POC). O POC é composto por organismos (vivos ou mortos), sua matéria fecal e detritos. O POC também é convertível em DOC por meio da desagregação de moléculas e da exsudação pelo fitoplâncton, por exemplo. O POC é geralmente convertido em DIC por meio de heterotrofia e respiração.
Bombas de carbono marítimas
Bomba de solubilidade

Os oceanos armazenam o maior conjunto de carbono reativo do planeta como DIC, introduzido como resultado da dissolução do dióxido de carbono atmosférico na água do mar – a bomba de solubilidade.[15] As concentrações aquosas de CO2, ácido carbônico, íon bicarbonato e íon carbonato compreendem o carbono inorgânico dissolvido (DIC). O DIC circula por todo o oceano por meio da circulação termoalina, o que facilita a enorme capacidade de armazenamento de DIC do oceano.[16] As equações químicas abaixo mostram as reações pelas quais o CO2 passa depois que entra no oceano e se transforma em sua forma aquosa.
-
(1)
O ácido carbônico se dissocia rapidamente em íons de hidrogênio livre (tecnicamente, hidrônio) e bicarbonato.
-
(2)
O íon de hidrogênio livre encontra o carbonato, já presente na água devido à dissolução do CaCO3, e reage para formar mais íons de bicarbonato.
-
(3)
As espécies dissolvidas nas equações acima, em sua maioria bicarbonato, compõem o sistema de alcalinidade de carbonato, o principal contribuinte para a alcalinidade da água do mar.[9]

Bomba de carbonato
A bomba de carbonato, às vezes chamada de contra bomba de carbonato, começa com organismos marinhos na superfície do oceano produzindo carbono inorgânico particulado (PIC) na forma de carbonato de cálcio (calcita ou aragonita, CaCO3). Esse CaCO3 é o que forma partes duras do corpo, como as conchas.[15] A formação dessas conchas aumenta o CO2 atmosférico devido à produção de CaCO3 na seguinte reação com estequiometria simplificada:[17]
-
(4)
Os cocolitóforos, um grupo quase onipresente de fitoplâncton que produz conchas de carbonato de cálcio, são os principais contribuintes para a bomba de carbonato.[15] Devido à sua abundância, os cocolitóforos têm implicações significativas na química do carbonato, nas águas superficiais que habitam e no oceano abaixo: eles fornecem um grande mecanismo para o transporte descendente de CaCO3.[19] O fluxo de CO2 ar-mar induzido por uma comunidade biológica marinha pode ser determinado pela razão de precipitação - a proporção de carbono do carbonato de cálcio em comparação com a do carbono orgânico no material particulado que afunda no fundo do oceano (PIC/POC).[18] A bomba de carbonato atua como um feedback negativo sobre o CO2 levado para o oceano pela bomba de solubilidade. Ela ocorre em menor magnitude do que a bomba de solubilidade.

Bomba biológica
O carbono orgânico particulado, criado por meio da produção biológica, pode ser liberado do oceano superior em um fluxo comumente chamado de bomba biológica, ou respirado (equação 6) de volta em carbono inorgânico. No primeiro caso, o carbono inorgânico dissolvido é biologicamente convertido em matéria orgânica pela fotossíntese (equação 5) e outras formas de autotrofismo[15] que, em seguida, afunda e é, em parte ou totalmente, digerida por heterótrofos.[20] O carbono orgânico particulado pode ser classificado como lábil [en], semilábil ou refratário, conforme a facilidade com que os organismos podem decompô-lo para obter alimentos. A fotossíntese pelo fitoplâncton é a principal fonte de moléculas lábeis e semilábeis, e é a fonte indireta da maioria das moléculas refratárias.[21][22] As moléculas lábeis estão presentes em baixas concentrações fora das células (na faixa de picomolar) e têm meia-vida de apenas alguns minutos quando livres no oceano.[23] Elas são consumidas pelos micróbios dentro de horas ou dias após a produção e estão presentes na superfície dos oceanos,[22] onde contribuem com a predominância do fluxo de carbono lábil.[24] As moléculas semilábeis, muito mais difíceis de consumir, podem atingir profundidades de centenas de metros abaixo da superfície antes de serem metabolizadas.[25] A MOD refratária é composta em grande parte por moléculas altamente conjugadas, como hidrocarbonetos aromáticos policíclicos ou lignina.[21] MOD refratária pode atingir profundidades superiores a 1 000 m e circula pelos oceanos durante milhares de anos.[22][26][27] Ao longo de um ano, aproximadamente 20 gigatoneladas de carbono lábil e semilábil fixado fotossinteticamente são absorvidas pelos heterótrofos, enquanto menos de 0,2 gigatonelada de carbono refratário é consumido.[22] A matéria orgânica marinha dissolvida (MOD) pode armazenar tanto carbono quanto o atual suprimento de CO2 atmosférico,[27] mas os processos industriais estão alterando o equilíbrio deste ciclo.[28]
-
(5)
-
(6)
Entradas
As entradas para o ciclo de carbono marinho são numerosas, mas as principais contribuições, em uma base líquida, vêm da atmosfera e dos rios.[1] As fissuras hidrotermais geralmente fornecem carbono equivalente à quantidade que consomem.[15]

Atmosfera
Antes da Revolução Industrial, o oceano era uma fonte de CO2 para a atmosfera,[7] equilibrando o impacto do desgaste das rochas e do carbono orgânico particulado terrestre; agora ele se tornou um sumidouro para o excesso de CO2 atmosférico.[29] O dióxido de carbono é absorvido da atmosfera na superfície do oceano em uma taxa de troca que varia localmente e com o tempo,[30] mas, em média, os oceanos têm uma absorção líquida de cerca de 2,9 Pg (equivalente a 2,9 bilhões de toneladas métricas) de carbono do CO2 atmosférico por ano.[31] Como a solubilidade do dióxido de carbono aumenta quando a temperatura diminui, as áreas frias podem conter mais CO2 e ainda estar em equilíbrio com a atmosfera; em contrapartida, o aumento da temperatura da superfície do mar diminui a capacidade dos oceanos de absorver dióxido de carbono.[9][32] O Atlântico Norte e os mares nórdicos [en] têm a maior absorção de carbono por unidade de área do mundo[33] e, no Atlântico Norte, a convecção profunda transporta aproximadamente 197 Tg por ano de carbono não refratário para a profundidade.[34]

A taxa de absorção de CO2 pelo oceano tem aumentado com o tempo à medida que as concentrações atmosféricas de CO2 aumentam devido às emissões antropogênicas. No entanto, o sumidouro de carbono do oceano pode ser mais sensível à mudança climática do que se pensava anteriormente, e o aquecimento do oceano e as mudanças na circulação devido à mudança climática podem fazer com que o oceano absorva menos CO2 da atmosfera no futuro do que o esperado.[36]
Taxas de troca de dióxido de carbono entre o oceano e a atmosfera
As taxas de troca oceano-atmosférica de CO2 dependem da concentração de dióxido de carbono já presente na atmosfera e no oceano, da temperatura, da salinidade e da velocidade do vento.[37] Essa taxa de troca pode ser aproximada pela lei de Henry e pode ser calculada como S = kP, em que a solubilidade (S) do gás de dióxido de carbono é proporcional à quantidade de gás na atmosfera ou à sua pressão parcial.[1]
Fator de Revelle
Como o consumo oceânico de dióxido de carbono é limitado, o influxo de CO2 também pode ser descrito pelo fator de Revelle.[9][32] O fator de Revelle [en] é uma relação entre a mudança de dióxido de carbono e a mudança no carbono inorgânico dissolvido, que serve como indicador da dissolução de dióxido de carbono na camada mista, considerando a bomba de solubilidade. O fator de Revelle é uma expressão para caracterizar a eficiência termodinâmica do reservatório de DIC para absorver CO2 em bicarbonato. Quanto menor o fator de Revelle, maior a capacidade da água do oceano de absorver dióxido de carbono. Embora Revelle tenha calculado um fator de cerca de 10 em sua época, em um estudo de 2004 os dados mostraram um fator Revelle que varia de aproximadamente 9 em regiões tropicais de baixa latitude a 15 no oceano do sul próximo à Antártica.[38]
Rios
Os rios também podem transportar carbono orgânico para o oceano por meio de intemperismo ou erosão de rochas de aluminossilicato (equação 7) e carbonato (equação 8) em terra,
-
(7)
-
(8)
ou pela decomposição da vida (equação 5, por exemplo, material vegetal e do solo).[1] Os rios contribuem com quantidades aproximadamente iguais (~0,4 GtC/ano) de DIC e DOC para os oceanos.[1] Estima-se que aproximadamente 0,8 GtC (DIC + DOC) seja transportado anualmente dos rios para o oceano.[1] Os rios que deságuam na Baía de Chesapeake (rios Susquehanna, Potomac e James) contribuem com aproximadamente 0,004 Gt (6,5 x 1010 mols) de DIC por ano.[39] O transporte total de carbono dos rios representa aproximadamente 0,02% do carbono total na atmosfera.[40] Embora pareça pequeno, em escalas de tempo longas (de 1 000 a 10 000 anos), o carbono que entra nos rios (e, portanto, não entra na atmosfera) serve como um feedback estabilizador para o aquecimento do efeito estufa.[41]
Saídas

As principais saídas do sistema de carbono marinho são a preservação da matéria orgânica particulada (POC) e do carbonato de cálcio (PIC), bem como o intemperismo reverso [en].[1] Embora existam regiões com perda local de CO2 para a atmosfera e processos hidrotermais, não ocorre uma perda líquida no ciclo.[15]
Conservação de matéria orgânica
A sedimentação é um sumidouro de longo prazo para o carbono no oceano, bem como a maior perda de carbono do sistema oceânico.[42] Os sedimentos marinhos profundos e as formações geológicas são importantes, pois fornecem um registro completo da vida na Terra e uma importante fonte de combustível fóssil.[42] O carbono oceânico pode sair do sistema na forma de detritos que afundam e são enterrados no fundo do mar sem serem totalmente decompostos ou dissolvidos. Os sedimentos da superfície do assoalho oceânico são responsáveis por 1,75x1015 kg de carbono no ciclo global do carbono.[43] No máximo, 4% do carbono orgânico particulado da zona eufótica do Oceano Pacífico, onde ocorre a produção primária movida a luz, é enterrado em sedimentos marinhos.[42] Fica implícito, então, que como há uma entrada maior de matéria orgânica no oceano do que a que está sendo enterrada, uma grande parte dela é usada ou consumida dentro do sistema.
Destino do carbono orgânico que afunda
Historicamente, os sedimentos com os maiores teores de carbono orgânico eram frequentemente encontrados em áreas com alta produtividade da água superficial ou com baixas concentrações de oxigênio na água do fundo.[44] 90% do acúmulo de carbono orgânico ocorre em depósitos de deltas, plataformas continentais e encostas superiores;[45] isso se deve, em parte, ao curto tempo de exposição devido à menor distância até o fundo do mar e à composição da matéria orgânica já depositada nesses ambientes.[46] O enterramento de carbono orgânico também é sensível aos padrões climáticos: a taxa de acúmulo de carbono orgânico foi 50% maior durante o máximo glacial em comparação com os interglaciais.[47]
Degradação
O POC é decomposto por uma série de processos conduzidos por microorganismos, como metanogênese e redução de sulfato, antes de ser enterrado no fundo do mar.[48][49] A degradação do POC também resulta na produção microbiana de metano, o principal hidrato de gás nas margens continentais.[50] A lignina e o pólen são inerentemente resistentes à degradação, e alguns estudos mostram que as matrizes inorgânicas também podem proteger a matéria orgânica.[51] As taxas de preservação da matéria orgânica dependem de outras variáveis interdependentes que variam de forma não linear no tempo e no espaço.[52] Embora a decomposição da matéria orgânica ocorra rapidamente na presença de oxigênio, os micróbios que utilizam uma variedade de espécies químicas (por meio de gradientes redox) podem degradar a matéria orgânica em sedimentos anóxicos.[52] A profundidade de enterramento na qual a degradação é interrompida depende da taxa de sedimentação, da abundância relativa de matéria orgânica no sedimento, do tipo de matéria orgânica que está sendo enterrada e de inúmeras outras variáveis.[52] Embora a decomposição da matéria orgânica possa ocorrer em sedimentos anóxicos quando as bactérias usam outros oxidantes além do oxigênio (nitrato, sulfato, Fe3+), a decomposição tende a terminar antes da mineralização completa.[53] Isso ocorre devido à decomposição preferencial de moléculas lábeis em relação às moléculas refratárias.[53]
Enterramento
O enterramento de carbono orgânico é uma entrada de energia para ambientes biológicos subterrâneos e pode regular o oxigênio na atmosfera em escalas de tempo longas (> 10 000 anos).[47] O enterramento só pode ocorrer se o carbono orgânico chegar ao fundo do mar, tornando as plataformas continentais e as margens costeiras o maior depósito de carbono orgânico da produção primária terrestre e oceânica. Os fiordes, ou penhascos criados pela erosão glacial, também foram identificados como áreas de enterramento significativo de carbono, com taxas cem vezes maiores do que a média do oceano.[54] O carbono orgânico particulado é enterrado em sedimentos oceânicos, criando um caminho entre um reservatório de carbono rapidamente disponível no oceano e seu armazenamento em escalas de tempo geológicas. Uma vez que o carbono é sequestrado no fundo do mar, ele é considerado "carbono azul [en]". As taxas de enterramento podem ser calculadas como a diferença entre a taxa na qual a matéria orgânica afunda e a taxa na qual ela se decompõe.
Conservação do carbonato de cálcio
A precipitação de carbonato de cálcio é importante, pois resulta na perda de alcalinidade e na liberação de CO2 (Equação 4) e, portanto, uma mudança na taxa de preservação do carbonato de cálcio pode alterar a pressão parcial de CO2 na atmosfera da Terra.[15] O CaCO3 é supersaturado na grande maioria das águas superficiais do oceano e insaturado em profundidade,[9] o que significa que as conchas têm maior probabilidade de se dissolver à medida que afundam nas profundezas do oceano. O CaCO3 também pode ser dissolvido por meio de dissolução metabólica (ou seja, pode ser usado como alimento e excretado) e, portanto, os sedimentos do oceano profundo têm muito pouco carbonato de cálcio.[15] A precipitação e o enterramento do carbonato de cálcio no oceano removem o carbono inorgânico particulado do oceano e, por fim, formam o calcário.[15] Em escalas de tempo superiores a 500 000 anos, o clima da Terra é moderado pelo fluxo de carbono que entra e sai da litosfera.[55] As rochas formadas no fundo do mar do oceano são recicladas por meio de placas tectônicas de volta à superfície e desgastadas ou subduzidas no manto, e o carbono é liberado por vulcões.[1]
Impactos humanos
Os oceanos absorvem cerca de 25 a 31% do CO2 antropogênico.[56][57] Como o fator de Revelle aumenta com o aumento do CO2, uma fração menor do fluxo antropogênico será absorvida pelo oceano no futuro.[58] O aumento anual atual do CO2 atmosférico é de aproximadamente 4 a 5 gigatoneladas de carbono,[59] cerca de 2 a 3 ppm de CO2 por ano.[60][61] Isso induz a mudanças climáticas que impulsionam a concentração de carbono e os processos de feedback carbono-clima que modificam a circulação oceânica e as propriedades físicas e químicas da água do mar, o que altera a absorção de CO2.[62][63] A pesca excessiva e a poluição plástica dos oceanos contribuem para o estado degradado do maior sumidouro de carbono do mundo.[64][65]
Acidificação oceânica
O pH dos oceanos está diminuindo devido à absorção de CO2 atmosférico.[66] O aumento do dióxido de carbono dissolvido reduz a disponibilidade do íon carbonato, reduzindo o estado de saturação do CaCO3, o que torna termodinamicamente mais difícil a formação de conchas de CaCO3.[67] Os íons de carbonato se ligam preferencialmente aos íons de hidrogênio para formar bicarbonato,[9] portanto, uma redução na disponibilidade de íons de carbonato aumenta a quantidade de íons de hidrogênio não ligados e diminui a quantidade de bicarbonato formado (Equações 1-3). O pH é uma medida da concentração de íons de hidrogênio, em que um pH baixo significa que há mais íons de hidrogênio não ligados. O pH é, portanto, um indicador da especiação [en] de carbonato (o formato do carbono presente) nos oceanos e pode ser usado para avaliar a sua saúde.[67]
A lista de organismos que podem ser afetados pela acidificação dos oceanos inclui cocolitóforos e foraminíferos (a base da cadeia alimentar marinha [en] em muitas áreas), fontes de alimentos para humanos, como ostras e mexilhões,[68] e talvez o mais evidente, uma estrutura construída por organismos - os recifes de coral.[67] A maioria das águas superficiais permanecerá supersaturada em relação ao CaCO3 (calcita e aragonita) por algum tempo nas trajetórias atuais de emissões,[67] mas os organismos que necessitam de carbonato serão provavelmente substituídos em muitas áreas.[67] Os recifes de coral estão sob pressão devido à pesca excessiva, à poluição por nitrato e ao aquecimento das águas; a acidificação dos oceanos aumentará o estresse sobre estas importantes estruturas.[67]
Fertilização com ferro
A fertilização com ferro é uma faceta da geoengenharia, que manipula propositalmente o sistema climático da Terra, geralmente em aspectos do ciclo do carbono ou do forçamento radiativo. O interesse atual da geoengenharia é a possibilidade de acelerar a bomba biológica para aumentar a saída de carbono da superfície do oceano. Esse aumento da produção poderia, teoricamente, remover o excesso de dióxido de carbono da atmosfera para armazenamento no oceano profundo. Existem investigações em andamento sobre fertilização artificial.[69] Devido à escala do oceano e aos tempos de resposta rápidos das comunidades heterotróficas aos aumentos na produção primária, é difícil determinar se a fertilização com nutrientes limitantes resulta em um aumento na transferência de carbono.[69] Entretanto, a maioria da comunidade não acredita que essa seja uma abordagem razoável ou viável.[70]
Barragens e reservatórios
Existem mais de 16 milhões de barragens no mundo[71] que alteram o transporte de carbono dos rios para os oceanos.[72] Usando dados do banco de dados Global Reservoirs and Dams (Reservatórios e Barragens Globais), que contém aproximadamente 7 000 reservatórios que detêm 77% do volume total de água retida por barragens (8 000 km3), estima-se que o transporte de carbono para o oceano tenha diminuído 13% desde 1970 e a projeção é que chegue a 19% até 2030.[73] O excesso de carbono contido nos reservatórios pode emitir mais ~0,184 Gt de carbono para a atmosfera por ano[74] e mais ~0,2 GtC será enterrado em sedimentos.[73] Antes de 2000, as bacias dos rios Mississippi, Níger e Ganges eram responsáveis por 25 a 31% de todo o carbono enterrado nos reservatórios.[73] Após o ano 2000, as bacias dos rios Paraná (que abriga 70 represas) e Zambeze (que abriga o maior reservatório) excederam o enterramento registrado pelo Mississippi.[73] Outros grandes contribuintes para o enterramento de carbono causado por barragens ocorrem nos rios Danúbio, Amazonas, Yangtzé, Mekong, Ienissei e Tocantins.[73]
Ver também
Referências
- ↑ a b c d e f g h i j Schlesinger, William H.; Bernhardt, Emily S. (2013). Biogeochemistry: an analysis of global change (em inglês) 3d edition ed. Amsterdam Boston: Elsevier/Academic Press. ISBN 9780123858740
- ↑ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P. (13 de outubro de 2000). «The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System». Science (em inglês). 290 (5490): 291–296. ISSN 0036-8075. doi:10.1126/science.290.5490.291. Consultado em 19 de dezembro de 2024
- ↑ Redfield, Alfred C. (1958). «The Biological Control of Chemical Factors in the Environment». American Scientist (em inglês). 46 (3): 230A–221. ISSN 0003-0996. Consultado em 19 de dezembro de 2024
- ↑ «The Carbon Cycle». earthobservatory.nasa.gov (em inglês). 16 de junho de 2011. Consultado em 20 de dezembro de 2024
- ↑ a b «AR5 Climate Change 2013: The Physical Science Basis». IPCC (em inglês). Consultado em 20 de dezembro de 2024
- ↑ «Sabine et al. - The Oceanic Sink for Anthropogenic CO2». www.pmel.noaa.gov (em inglês). Consultado em 20 de dezembro de 2024
- ↑ a b c Ocean acidification due to increasing atmospheric carbon dioxide (PDF) (em inglês). London: The Royal Society. 2005. ISBN 0-85403-617-2
- ↑ Friedlingstein, Pierre; O'Sullivan, Michael; Jones, Matthew W.; Andrew, Robbie M.; Bakker, Dorothee C. E.; Hauck, Judith; Landschützer, Peter; Le Quéré, Corinne; Luijkx, Ingrid T. (5 de dezembro de 2023). «Global Carbon Budget 2023». Earth System Science Data (em inglês). 15 (12): 5301–5369. ISSN 1866-3516. doi:10.5194/essd-15-5301-2023. Consultado em 20 de dezembro de 2024
- ↑ a b c d e f Zeebe, Richard E.; Wolf-Gladrow, Dieter A. (2001). CO₂ in seawater: equilibrium, kinetics, isotopes. Col: Elsevier oceanography series (em inglês). Amsterdam ; New York: Elsevier. ISBN 978-0444509468
- ↑ Knight, J. (2009). «Global oceans: Do global temperature trends over the last decade falsify climate predictions?». Bulletin of the American Meteorological Society (em inglês). 90: 56–57
- ↑ Boyer, Tim. «Global Ocean Heat and Salt Content - Seasonal, Yearly, and Pentadal Fields». www.ncei.noaa.gov (em inglês). Consultado em 20 de dezembro de 2024
- ↑ Guemas, Virginie; Doblas-Reyes, Francisco J.; Andreu-Burillo, Isabel; Asif, Muhammad (julho de 2013). «Retrospective prediction of the global warming slowdown in the past decade». Nature Climate Change (em inglês). 3 (7): 649–653. ISSN 1758-678X. doi:10.1038/nclimate1863. Consultado em 20 de dezembro de 2024
- ↑ Wilson, R. W.; Millero, F. J.; Taylor, J. R.; Walsh, P. J.; Christensen, V.; Jennings, S.; Grosell, M. (16 de janeiro de 2009). «Contribution of Fish to the Marine Inorganic Carbon Cycle». Science (em inglês). 323 (5912): 359–362. ISSN 0036-8075. doi:10.1126/science.1157972. Consultado em 22 de dezembro de 2024
- ↑ Emerson, Steven; Hedges, John (2008). Chemical oceanography and the marine carbon cycle (em inglês). Cambridge: Cambridge University Press. ISBN 978-0-521-83313-4. OCLC 183916203
- ↑ a b c d e f g h i Emerson, Steven; Hedges, John (2008). Chemical oceanography and the marine carbon cycle (em inglês). Cambridge: Cambridge University Press. ISBN 978-0-521-83313-4
- ↑ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P. (13 de outubro de 2000). «The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System». Science (em inglês). 290 (5490): 291–296. ISSN 0036-8075. doi:10.1126/science.290.5490.291. Consultado em 23 de dezembro de 2024
- ↑ Smith, Stephen V. (2013). Parsing the Oceanic Calcium Carbonate Cycle: A Net Atmospheric Carbon Dioxide Source, or a Sink? (em inglês). : ASLO. ISBN 978-0-9845591-2-1
- ↑ a b Smith, S. V.; Key, G. S. (maio de 1975). «Carbon dioxide and metabolism in marine environments1». Limnology and Oceanography (em inglês). 20 (3): 493–495. ISSN 0024-3590. doi:10.4319/lo.1975.20.3.0493. Consultado em 23 de dezembro de 2024
- ↑ Rost, Björn; Riebesell, Ulf (2004). Thierstein, Hans R.; Young, Jeremy R., eds. «Coccolithophores and the biological pump: responses to environmental changes». Berlin, Heidelberg: Springer Berlin Heidelberg (em inglês): 99–125. ISBN 978-3-642-06016-8. doi:10.1007/978-3-662-06278-4_5. Consultado em 23 de dezembro de 2024
- ↑ Kim, Sunghwan; Kramer, Robert W.; Hatcher, Patrick G. (15 de outubro de 2003). «Graphical Method for Analysis of Ultrahigh-Resolution Broadband Mass Spectra of Natural Organic Matter, the Van Krevelen Diagram». Analytical Chemistry (em inglês). 75 (20): 5336–5344. ISSN 0003-2700. doi:10.1021/ac034415p. Consultado em 24 de dezembro de 2024
- ↑ a b Brophy, Jennifer E.; Carlson, David J. (abril de 1989). «Production of biologically refractory dissolved organic carbon by natural seawater microbial populations». Deep Sea Research Part A. Oceanographic Research Papers (em inglês). 36 (4): 497–507. doi:10.1016/0198-0149(89)90002-2. Consultado em 24 de dezembro de 2024
- ↑ a b c d Moran, Mary Ann; Kujawinski, Elizabeth B.; Stubbins, Aron; Fatland, Rob; Aluwihare, Lihini I.; Buchan, Alison; Crump, Byron C.; Dorrestein, Pieter C.; Dyhrman, Sonya T. (22 de março de 2016). «Deciphering ocean carbon in a changing world». Proceedings of the National Academy of Sciences (em inglês). 113 (12): 3143–3151. ISSN 0027-8424. PMC 4812754
 . PMID 26951682. doi:10.1073/pnas.1514645113. Consultado em 24 de dezembro de 2024
. PMID 26951682. doi:10.1073/pnas.1514645113. Consultado em 24 de dezembro de 2024
- ↑ Azam, Farooq; Malfatti, Francesca (outubro de 2007). «Microbial structuring of marine ecosystems». Nature Reviews Microbiology (em inglês). 5 (10): 782–791. ISSN 1740-1526. doi:10.1038/nrmicro1747. Consultado em 24 de dezembro de 2024
- ↑ Morán, Xag; Ducklow, Hw; Erickson, M (28 de agosto de 2013). «Carbon fluxes through estuarine bacteria reflect coupling with phytoplankton». Marine Ecology Progress Series (em inglês). 489: 75–85. ISSN 0171-8630. doi:10.3354/meps10428. Consultado em 24 de dezembro de 2024
- ↑ Hansell, Dennis A.; Carlson, Craig A. (setembro de 1998). «Net community production of dissolved organic carbon». Global Biogeochemical Cycles (em inglês). 12 (3): 443–453. ISSN 0886-6236. doi:10.1029/98GB01928. Consultado em 24 de dezembro de 2024
- ↑ Follett, Christopher L.; Repeta, Daniel J.; Rothman, Daniel H.; Xu, Li; Santinelli, Chiara (25 de novembro de 2014). «Hidden cycle of dissolved organic carbon in the deep ocean». Proceedings of the National Academy of Sciences (em inglês). 111 (47): 16706–16711. ISSN 0027-8424. PMC 4250131
 . PMID 25385632. doi:10.1073/pnas.1407445111. Consultado em 24 de dezembro de 2024
. PMID 25385632. doi:10.1073/pnas.1407445111. Consultado em 24 de dezembro de 2024
- ↑ a b Hansell, Dennis A. (3 de janeiro de 2013). «Recalcitrant Dissolved Organic Carbon Fractions». Annual Review of Marine Science (em inglês). 5 (1): 421–445. ISSN 1941-1405. doi:10.1146/annurev-marine-120710-100757. Consultado em 24 de dezembro de 2024
- ↑ Doney, Scott C.; Ruckelshaus, Mary; Emmett Duffy, J.; Barry, James P.; Chan, Francis; English, Chad A.; Galindo, Heather M.; Grebmeier, Jacqueline M.; Hollowed, Anne B. (15 de janeiro de 2012). «Climate Change Impacts on Marine Ecosystems». Annual Review of Marine Science (em inglês). 4 (1): 11–37. ISSN 1941-1405. doi:10.1146/annurev-marine-041911-111611. Consultado em 24 de dezembro de 2024
- ↑ Gruber, Nicolas; Gloor, Manuel; Mikaloff Fletcher, Sara E.; Doney, Scott C.; Dutkiewicz, Stephanie; Follows, Michael J.; Gerber, Markus; Jacobson, Andrew R.; Joos, Fortunat (março de 2009). «Oceanic sources, sinks, and transport of atmospheric CO 2». Global Biogeochemical Cycles (em inglês). 23 (1). ISSN 0886-6236. doi:10.1029/2008GB003349. Consultado em 24 de dezembro de 2024
- ↑ Takahashi, Taro; Sutherland, Stewart C.; Sweeney, Colm; Poisson, Alain; Metzl, Nicolas; Tilbrook, Bronte; Bates, Nicolas; Wanninkhof, Rik; Feely, Richard A. (janeiro de 2002). «Global sea–air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects». Deep Sea Research Part II: Topical Studies in Oceanography (em inglês). 49 (9-10): 1601–1622. doi:10.1016/S0967-0645(02)00003-6. Consultado em 24 de dezembro de 2024
- ↑ Friedlingstein, Pierre; O'Sullivan, Michael; Jones, Matthew W.; Andrew, Robbie M.; Bakker, Dorothee C. E.; Hauck, Judith; Landschützer, Peter; Le Quéré, Corinne; Luijkx, Ingrid T. (5 de dezembro de 2023). «Global Carbon Budget 2023». Earth System Science Data (em inglês). 15 (12): 5301–5369. ISSN 1866-3516. doi:10.5194/essd-15-5301-2023. Consultado em 24 de dezembro de 2024
- ↑ a b Revelle, Roger; Suess, Hans E. (fevereiro de 1957). «Carbon Dioxide Exchange Between Atmosphere and Ocean and the Question of an Increase of Atmospheric CO 2 during the Past Decades». Tellus (em inglês). 9 (1): 18–27. doi:10.1111/j.2153-3490.1957.tb01849.x. Consultado em 24 de dezembro de 2024
- ↑ Takahashi, Taro; Sutherland, Stewart C.; Wanninkhof, Rik; Sweeney, Colm; Feely, Richard A.; Chipman, David W.; Hales, Burke; Friederich, Gernot; Chavez, Francisco (abril de 2009). «Climatological mean and decadal change in surface ocean pCO2, and net sea–air CO2 flux over the global oceans». Deep Sea Research Part II: Topical Studies in Oceanography (em inglês). 56 (8-10): 554–577. doi:10.1016/j.dsr2.2008.12.009. Consultado em 24 de dezembro de 2024
- ↑ Fontela, Marcos; García-Ibáñez, Maribel I.; Hansell, Dennis A.; Mercier, Herlé; Pérez, Fiz F. (31 de maio de 2016). «Dissolved Organic Carbon in the North Atlantic Meridional Overturning Circulation». Scientific Reports (em inglês). 6 (1). ISSN 2045-2322. PMC 4886255
 . PMID 27240625. doi:10.1038/srep26931. Consultado em 24 de dezembro de 2024
. PMID 27240625. doi:10.1038/srep26931. Consultado em 24 de dezembro de 2024
- ↑ Capelle, David W.; Kuzyk, Zou Zou A.; Papakyriakou, Tim; Guéguen, Céline; Miller, Lisa A.; Macdonald, Robie W. (junho de 2020). «Effect of terrestrial organic matter on ocean acidification and CO2 flux in an Arctic shelf sea». Progress in Oceanography (em inglês). 102319 páginas. doi:10.1016/j.pocean.2020.102319. Consultado em 24 de dezembro de 2024
- ↑ Gruber, Nicolas; Bakker, Dorothee C. E.; DeVries, Tim; Gregor, Luke; Hauck, Judith; Landschützer, Peter; McKinley, Galen A.; Müller, Jens Daniel (24 de janeiro de 2023). «Trends and variability in the ocean carbon sink». Nature Reviews Earth & Environment (em inglês). 4 (2): 119–134. ISSN 2662-138X. doi:10.1038/s43017-022-00381-x. Consultado em 24 de dezembro de 2024
- ↑ Robbins, L. L.; Hansen, M. E.; Kleypas, J. A.; Meylan, S. C. (2010). «CO2calc: A User-Friendly Seawater Carbon Calculator for Windows, Mac OS X, and iOS (iPhone)». U.S. Geological Survey Open-File Report 2010 (em inglês). doi:10.3133/ofr20101280. Consultado em 24 de dezembro de 2024
- ↑ Sabine, Christopher L.; Feely, Richard A.; Gruber, Nicolas; Key, Robert M.; Lee, Kitack; Bullister, John L.; Wanninkhof, Rik; Wong, C. S.; Wallace, Douglas W. R. (16 de julho de 2004). «The Oceanic Sink for Anthropogenic CO 2». Science (em inglês). 305 (5682): 367–371. ISSN 0036-8075. doi:10.1126/science.1097403. Consultado em 25 de dezembro de 2024
- ↑ Waldbusser, George G.; Powell, Eric N.; Mann, Roger (abril de 2013). «Ecosystem effects of shell aggregations and cycling in coastal waters: an example of Chesapeake Bay oyster reefs». Ecology (em inglês). 94 (4): 895–903. ISSN 0012-9658. doi:10.1890/12-1179.1. Consultado em 25 de dezembro de 2024
- ↑ Galy, Valier; Peucker-Ehrenbrink, Bernhard; Eglinton, Timothy (maio de 2015). «Global carbon export from the terrestrial biosphere controlled by erosion». Nature (em inglês). 521 (7551): 204–207. ISSN 0028-0836. doi:10.1038/nature14400. Consultado em 25 de dezembro de 2024
- ↑ Velbel, Michael Anthony (1993). «Temperature dependence of silicate weathering in nature: How strong a negative feedback on long-term accumulation of atmospheric CO2 and global greenhouse warming?». Geology (em inglês). 21 (12). 1059 páginas. ISSN 0091-7613. doi:10.1130/0091-7613(1993)021<1059:TDOSWI>2.3.CO;2. Consultado em 25 de dezembro de 2024
- ↑ a b c Emerson, S.; Hedges, J. I. (outubro de 1988). «Processes controlling the organic carbon content of open ocean sediments». Paleoceanography (em inglês). 3 (5): 621–634. ISSN 0883-8305. doi:10.1029/PA003i005p00621. Consultado em 27 de dezembro de 2024
- ↑ Ciais, Philippe; Sabine, Christopher (2013). «Carbon and Other Biogeochemical Cycles». Climate Change 2013: the physical science basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press
- ↑ Fleming, R.H.; Revelle, R. (1939). «Physical processes in the oceans». Recent Marine Sediments (em inglês). Tulsa: American Association of Petroleum Geologists
- ↑ Berner, Robert A. (janeiro de 1989). «Biogeochemical cycles of carbon and sulfur and their effect on atmospheric oxygen over phanerozoic time». Palaeogeography, Palaeoclimatology, Palaeoecology (em inglês). 75 (1-2): 97–122. doi:10.1016/0031-0182(89)90186-7. Consultado em 27 de dezembro de 2024
- ↑ Henrichs, Susan M. (setembro de 1992). «Early diagenesis of organic matter in marine sediments: progress and perplexity». Marine Chemistry (em inglês). 39 (1-3): 119–149. doi:10.1016/0304-4203(92)90098-U. Consultado em 27 de dezembro de 2024
- ↑ a b Cartapanis, Olivier; Bianchi, Daniele; Jaccard, Samuel L.; Galbraith, Eric D. (29 de fevereiro de 2016). «Global pulses of organic carbon burial in deep-sea sediments during glacial maxima». Nature Communications (em inglês). 7 (1). ISSN 2041-1723. PMC 4773493
 . PMID 26923945. doi:10.1038/ncomms10796. Consultado em 27 de dezembro de 2024
. PMID 26923945. doi:10.1038/ncomms10796. Consultado em 27 de dezembro de 2024
- ↑ Claypool, G.E.; Kaplan, I.R. (1974). Natural Gases in Marine Sediments (em inglês). New York: Plenum Press
- ↑ D'Hondt, Steven; Rutherford, Scott; Spivack, Arthur J. (15 de março de 2002). «Metabolic Activity of Subsurface Life in Deep-Sea Sediments». Science (em inglês). 295 (5562): 2067–2070. ISSN 0036-8075. doi:10.1126/science.1064878. Consultado em 27 de dezembro de 2024
- ↑ Kvenvolden, K.A.; Lorenson, T.D. (2001). Paull, Charles K.; Dillon, William P., eds. Natural gas hydrates: occurrence, distribution, and detection. Col: Geophysical monograph (em inglês). Washington, DC: American Geophysical Union. ISBN 978-0-875-90982-0
- ↑ Huguet, Carme; de Lange, Gert J.; Gustafsson, Örjan; Middelburg, Jack J.; Sinninghe Damsté, Jaap S.; Schouten, Stefan (dezembro de 2008). «Selective preservation of soil organic matter in oxidized marine sediments (Madeira Abyssal Plain)». Geochimica et Cosmochimica Acta (em inglês). 72 (24): 6061–6068. doi:10.1016/j.gca.2008.09.021. Consultado em 27 de dezembro de 2024
- ↑ a b c Hedges, J. I. (1 de novembro de 1999). «Sedimentary organic matter preservation; a test for selective degradation under oxic conditions». American Journal of Science (em inglês). 299 (7-9): 529–555. ISSN 0002-9599. doi:10.2475/ajs.299.7-9.529. Consultado em 27 de dezembro de 2024
- ↑ a b Kristensen, Erik; Ahmed, Saiyed I.; Devol, Allan H. (dezembro de 1995). «Aerobic and anaerobic decomposition of organic matter in marine sediment: Which is fastest?». Limnology and Oceanography (em inglês). 40 (8): 1430–1437. ISSN 0024-3590. doi:10.4319/lo.1995.40.8.1430. Consultado em 27 de dezembro de 2024
- ↑ Smith, Richard W.; Bianchi, Thomas S.; Allison, Mead; Savage, Candida; Galy, Valier (junho de 2015). «High rates of organic carbon burial in fjord sediments globally». Nature Geoscience (em inglês). 8 (6): 450–453. ISSN 1752-0894. doi:10.1038/ngeo2421. Consultado em 27 de dezembro de 2024
- ↑ Kasting, James F.; Toon, Owen B.; Pollack, James B. (fevereiro de 1988). «How Climate Evolved on the Terrestrial Planets». Scientific American. 258 (2): 90–97. ISSN 0036-8733. doi:10.1038/scientificamerican0288-90. Consultado em 27 de dezembro de 2024
- ↑ Gruber, Nicolas; Clement, Dominic; Carter, Brendan R.; Feely, Richard A.; van Heuven, Steven; Hoppema, Mario; Ishii, Masao; Key, Robert M.; Kozyr, Alex (15 de março de 2019). «The oceanic sink for anthropogenic CO 2 from 1994 to 2007». Science (em inglês). 363 (6432): 1193–1199. ISSN 0036-8075. doi:10.1126/science.aau5153. Consultado em 27 de dezembro de 2024
- ↑ Gruber, Nicolas; Bakker, Dorothee C. E.; DeVries, Tim; Gregor, Luke; Hauck, Judith; Landschützer, Peter; McKinley, Galen A.; Müller, Jens Daniel (24 de janeiro de 2023). «Trends and variability in the ocean carbon sink». Nature Reviews Earth & Environment (em inglês). 4 (2): 119–134. ISSN 2662-138X. doi:10.1038/s43017-022-00381-x. Consultado em 27 de dezembro de 2024
- ↑ Revelle, Roger; Suess, Hans E. (fevereiro de 1957). «Carbon Dioxide Exchange Between Atmosphere and Ocean and the Question of an Increase of Atmospheric CO 2 during the Past Decades». Tellus (em inglês). 9 (1): 18–27. doi:10.1111/j.2153-3490.1957.tb01849.x. Consultado em 27 de dezembro de 2024
- ↑ Friedlingstein, Pierre; O'Sullivan, Michael; Jones, Matthew W.; Andrew, Robbie M.; Bakker, Dorothee C. E.; Hauck, Judith; Landschützer, Peter; Le Quéré, Corinne; Luijkx, Ingrid T. (5 de dezembro de 2023). «Global Carbon Budget 2023». Earth System Science Data (em inglês). 15 (12): 5301–5369. ISSN 1866-3516. doi:10.5194/essd-15-5301-2023. Consultado em 27 de dezembro de 2024
- ↑ «Greenhouse gas concentrations | Copernicus». climate.copernicus.eu (em inglês). Consultado em 27 de dezembro de 2024
- ↑ «Climate Change: Atmospheric Carbon Dioxide | NOAA Climate.gov». www.climate.gov (em inglês). 9 de abril de 2024. Consultado em 27 de dezembro de 2024
- ↑ Boer, G. J.; Arora, V. K. (15 de maio de 2013). «Feedbacks in Emission-Driven and Concentration-Driven Global Carbon Budgets». Journal of Climate (em inglês). 26 (10): 3326–3341. ISSN 0894-8755. doi:10.1175/JCLI-D-12-00365.1. Consultado em 27 de dezembro de 2024
- ↑ Gregory, J. M.; Jones, C. D.; Cadule, P.; Friedlingstein, P. (1 de outubro de 2009). «Quantifying Carbon Cycle Feedbacks». Journal of Climate (em inglês). 22 (19): 5232–5250. ISSN 1520-0442. doi:10.1175/2009JCLI2949.1. Consultado em 27 de dezembro de 2024
- ↑ Harvey, Fiona (4 de dezembro de 2019). «Tackling degraded oceans could mitigate climate crisis - report». The Guardian (em inglês). ISSN 0261-3077. Consultado em 27 de dezembro de 2024
- ↑ Harvey, Fiona (7 de dezembro de 2019). «Oceans losing oxygen at unprecedented rate, experts warn». The Guardian (em inglês). ISSN 0261-3077. Consultado em 27 de dezembro de 2024
- ↑ Caldeira, Ken; Wickett, Michael E. (setembro de 2003). «Anthropogenic carbon and ocean pH». Nature (em inglês). 425 (6956): 365–365. ISSN 0028-0836. doi:10.1038/425365a. Consultado em 27 de dezembro de 2024
- ↑ a b c d e f Gattuso, Jean-Pierre; Hansson, Lina, eds. (2011). Ocean acidification (em inglês). Oxford ; New York: Oxford University Press. ISBN 9780199591091. OCLC 730413873
- ↑ Whiskey Creek Shellfish Hatchery; Barton, Alan; Waldbusser, George; Feely, Richard; Weisberg, Stephen; Newton, Jan; Hales, Burke; Cudd, Sue; Eudeline, Benoit (1 de junho de 2015). «Impacts of Coastal Acidification on the Pacific Northwest Shellfish Industry and Adaptation Strategies Implemented in Response». Oceanography (em inglês). 25 (2): 146–159. doi:10.5670/oceanog.2015.38. Consultado em 27 de dezembro de 2024
- ↑ a b Aumont, O.; Bopp, L. (junho de 2006). «Globalizing results from ocean in situ iron fertilization studies». Global Biogeochemical Cycles (em inglês). 20 (2). ISSN 0886-6236. doi:10.1029/2005GB002591. Consultado em 28 de dezembro de 2024
- ↑ Chisholm, Sallie W.; Falkowski, Paul G.; Cullen, John J. (12 de outubro de 2001). «Dis-Crediting Ocean Fertilization». Science (em inglês). 294 (5541): 309–310. ISSN 0036-8075. doi:10.1126/science.1065349. Consultado em 28 de dezembro de 2024
- ↑ Lehner, Bernhard; Liermann, Catherine Reidy; Revenga, Carmen; Vörösmarty, Charles; Fekete, Balazs; Crouzet, Philippe; Döll, Petra; Endejan, Marcel; Frenken, Karen (novembro de 2011). «High‐resolution mapping of the world's reservoirs and dams for sustainable river‐flow management». Frontiers in Ecology and the Environment (em inglês). 9 (9): 494–502. ISSN 1540-9295. doi:10.1890/100125. Consultado em 28 de dezembro de 2024
- ↑ Regnier, Pierre; Friedlingstein, Pierre; Ciais, Philippe; Mackenzie, Fred T.; Gruber, Nicolas; Janssens, Ivan A.; Laruelle, Goulven G.; Lauerwald, Ronny; Luyssaert, Sebastiaan (agosto de 2013). «Anthropogenic perturbation of the carbon fluxes from land to ocean». Nature Geoscience (em inglês). 6 (8): 597–607. ISSN 1752-0894. doi:10.1038/ngeo1830. Consultado em 28 de dezembro de 2024
- ↑ a b c d e Maavara, Taylor; Lauerwald, Ronny; Regnier, Pierre; Van Cappellen, Philippe (17 de maio de 2017). «Global perturbation of organic carbon cycling by river damming». Nature Communications (em inglês). 8 (1). ISSN 2041-1723. PMC 442313
 . PMID 28513580. doi:10.1038/ncomms15347. Consultado em 28 de dezembro de 2024
. PMID 28513580. doi:10.1038/ncomms15347. Consultado em 28 de dezembro de 2024
- ↑ Barros, Nathan; Cole, Jonathan J.; Tranvik, Lars J.; Prairie, Yves T.; Bastviken, David; Huszar, Vera L. M.; del Giorgio, Paul; Roland, Fábio (setembro de 2011). «Carbon emission from hydroelectric reservoirs linked to reservoir age and latitude». Nature Geoscience (em inglês). 4 (9): 593–596. ISSN 1752-0894. doi:10.1038/ngeo1211. Consultado em 28 de dezembro de 2024







