Elemento químico representativo
Neste artigo vamos nos aprofundar no mundo de Elemento químico representativo, um tema que tem chamado a atenção de muitas pessoas e que desperta grande interesse na sociedade atual. Nesta linha iremos explorar os diferentes aspectos relacionados com Elemento químico representativo, desde a sua história e evolução, até ao seu impacto hoje. Além disso, analisaremos as possíveis implicações e consequências que Elemento químico representativo pode ter em diferentes áreas, bem como as opiniões e perspectivas de especialistas na área. Sem dúvida, Elemento químico representativo é um tema que não deixa ninguém indiferente, por isso é fundamental examiná-lo com atenção e refletir sobre a sua importância no mundo atual.
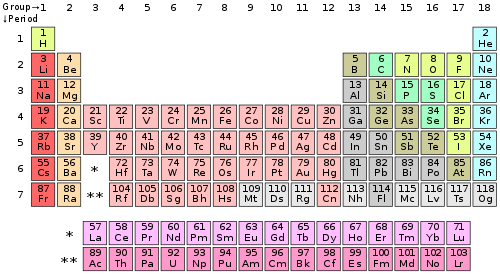
Elementos químicos representativos são, na química e física atômica, o grupo de elementos cujos membros mais leves são representados pelo hélio, lítio, berílio, boro, carbono, nitrogênio, oxigênio e flúor, como disposto na tabela periódica dos elementos. Os elementos representativos incluem os elementos (exceto o hidrogênio) dos grupos 1 e 2 (bloco s), e os grupos de 13 a 18 (bloco p). Os elementos do grupo 12 são considerados metais de transição; no entanto, zinco, cádmio, e mercúrio compartilham algumas propriedades com ambos os grupos (representativos e de transição), portanto alguns cientistas acreditam que eles devem ser incluídos no grupo dos elementos representativos.[1][2]
Na Terra, os elementos representativos são os mais abundantes, bem como no Sistema Solar e no universo.
Configuração eletrônica
A configuração eletrônica dos elementos representativos apresenta o último nível com a seguinte distribuição:
- ns¹;
- ns², ou em
- ns² np1 a 5, onde n é o número quântico principal do último nível de energia.
Desta forma, temos:
- Metais alcalinos (grupo 1): ns¹
Ver também
Referências
- ↑ «Nomenclature of Inorganic Chemistry». International Union of Pure and Applied Chemistry. Consultado em 27 de setembro de 2011
- ↑ Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table» (PDF). Journal of Chemical Education. 80 (8): 952–561. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952